
1. Inleiding
Men hoort de laatste jaren een hoop geruchten
en geroddel over sommige bijproducten, o.a. glycerines en
meer bepaaald ongeraffineerde glycerines (de enige waarvan
de prijs aanvaardbaar is voor de vergistingssector).
Uiteraard zijn een aantal vergisters met
glycerines onlangs (2011) tegen de muur gelopen. Zijn
de glycerines daarvoor slechte/gevaarlijke producten?
- JA wanneer ze wild ingezet worden
zonder voorzorg maatregelen.
- NEE wanneer ze rationeel en voedingskundig
worden gebruikt
Deze werden een beetje wild ingezet in de
rantsoenen. In dit artikel geven wij antwoord op wat er is
gebeurd.
Als nutritionnisten zijn wij niet tevreden
met niet ondersteunde uitleg over één of ander
product. In dit artikel geven wij een aantal antwoorden:
- Hoe worden de glycerines geproduceerd?
M.a.w. welke andere nutriënten dan glycerol zouden
wij kunnen vinden in die glycerines die de werking van een
vergister kunnen schaden?
- Natrium chloride (zout) of natriumacetaat?
uit ten boze? Vanaf welke dosis?
- Verantwoord gebruik van glycerines.
Hoe gaat men te werk? C/N verhouding en dergelijke
vereenvoudigde ratio's zijn totaal onvoldoende om een goed
rantsoen op te stellen. Een bioingenieur nutritionist studeert
5 jaar aan de universiteit. Dit geeft toch wel het idee
dat een goed en secuur rantsoen iets complexer is dan een
C/N verhouding.
2. Waar vindt men glycerine in de natuur?
Glycerol (de andere naam voor glycerine)
is een biomolecule die men terugvindt in alle triglyceriden
(oliën en vetten).
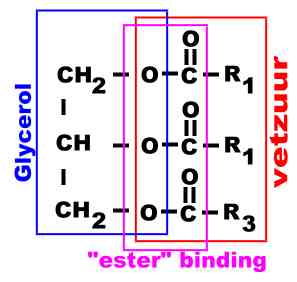
Een triglyceride is gebouwd uit 1 molecule
glycerol en drie vetzuurmoleculen:
 |
of |
 |
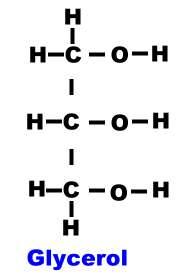 |
Glycerol is een tertiair alcohol
(3 alcohol functies). Het is een koolhydraat (koolhydraat
met 3 koolstof atomen).
Glycerol is een neutrale/zwak zure molecule in waterige
oplossingen.
Glycerines bevatten voornamelijk glycerol maar kunnen
evenwel andere nutriënten bevatten (natrium, chloriden,
azijnzuur of zouten...) volgens het toegepaste procedé
waarbij ze vrijkomen. |
|

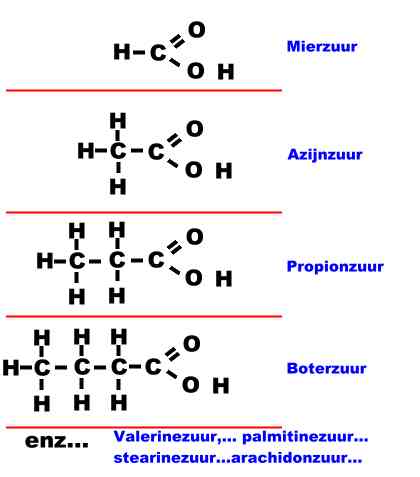
Het andere component van vetten en oliën
zijn vetzuren:
 |
Wanneer de oleochemische
industrie oliën en vetten behandelen is het meestal
om de vetzuren ervan te extraheren.
Maar hiervoor moet
men de vetzuren kunnen afzonderen. Hiervan zal de kwaliteit
van de glycerine afhangen. |
Waarom zijn de vetzuren veresterd met glycerol
in levende cellen van hogere organismen?
Elke levende cel slaat het grootste gedeelte
van de energie op in de vorm van vetten. De inhoud van de
cel moet op neutraal pH blijven om te kunnen werken. Maar
vetzuren, zoals hun naam het voorstelt, zijn zuren die de
cel zouden doden door verzuring indien ze dusdanig waren opgeslaan.
De levende wezens lossen dit op door de vetzuren te combineren
met glycerol (vetzuren worden biologisch veresterd met glycerol).
Triglyceriden zijn neutraal op het gebied van het pH. Voor
diegenen die een beetje thuis zijn in organische scheikunde:
alcohol + carboxilisch zuur => ester +
water
Wanneer men aan olie en vetwinning doet verkrijgt
men steeds triglyceriden. Daar zit het hem, de oleochemische
industrie heeft hoofdzakelijk vetzuren nodig en niet triglyceriden.
Glycerines zijn een bijproduct van dit type industrie. Dit
brengt ons tot de verschillende procedé's waarbij glycerine
vrij komt.
3. Productieprocédé's van
glycerine
Wanneer men een industrieel product wil gaan
gebruiken moet men steeds dezelfde stappen zetten, dat het
nu om glycerine, mayonnaise, waterstoppen, slibs... gaat:
- Productieprocédé overlopen,
ingrediëneten en gebruikte hulpstoffen identificeren.
Hiermee kan men reeds vroegtijdig de nodige analysen van
de derde stap bepalen.
- Wat kan er mislopen tijdens het productieprocédé
en hoe verhelpt de industrieel dit (behandeling met zwavelzuur,
soda, zepen enz...)
- Analyse: dit is een stap dat nooit liegt
over een product. Alle mogelijke analyses uitvoeren zou
een peperdure oplossing zijn die de twee eerste stappen
onnodig zou maken. Met de twee eerste stappen kan men reeds
de belangrijke nodige extra-analyseparameters bepalen. Verder
moet voor elk product dat in de biologie van de vergister
belandt de standard voedingskundige ontledingen laten uitvoeren.
Laat ons deze reeks stappen zetten voor de
glycerines:
|

3.1 Transesterificatie (biodieselindustrie)
Wij hebben zojuist gezien dat oliën
en vetten esters zijn van glycerol en vetzuren.
Technisch gezien kan men een diesel motor
laten functionneren met triglyceriden. Er bestaan redenen
waardoor dit niet is aangewzen:
- triglyceriden zijn niet erg vluchtig.
- de viscositeit van triglyceriden varieert
sterk met de temperatuur. Deze kunnen zelfs stollen op koudere
temperaturen
In de biodieselindustrie gaat men dus een
transesterificatie uitvoeren. Zoals het woord het laat gissen
is transesterificatie het verplaatsen van de vetzuren van
de eene ester (triacylglycerol = triglyceride) naar een andere
ester (methylester of een ethylester = biodiesel), en dit
in één stap.
De transesterificatiereactie vereist de aanwezigheid
van een alkalische katalysator. Meestal gebruikt men caustic
soda (=natriumhydroxyde=NaOH) omdat deze een goedkope sterke
base is.
Men plaatst dus alle reagentia in een reactor:
methanol (of ethanol), triglyceriden (olie), en natriumhydroxyde.
De reactie vindt plaats op kamertemperatuur maar om deze te
versnellen warmt men het mengsel op 50°C. De transesterificatie
vindt plaats en men verkrijgt 3 fasen in de reactor:
- bovenfase: de biodiesel (methyl of ethylester)
- middenfase: een mengsel methanol, water,
glycerine, natriumhydroxide en methylesters
- onderste fase: glycerol
Gezien glycerol oplosbaar is in water en
soda evenwel, is de glycerine gemengd met natrium hydroxide.
De fasen worden gescheiden (decantatie en/of
centrifugatie).
Omdat de glycerine + NaOH zeer alkalisch
is gaat men deze neutralizeren met een zuur. In principe kan
elk zuur worden gebruikt maar in de praktijk gebruikt men
meestal zoutzuur (HCl). Dit geeft dus een glycerineoplossing
die volgende nutriënten bevat:
- glycerine
- water (geen probleem)
- Natriumchloride (NaCl = tafelzout)
Als men dit type glycerine gebruikt moet
men uiteraard opletten voor natrium en chloriden. Anders vergiftigt
men de biologie van de vergister. Bij het formuleren moet
men ook rekening houden met de totale drogestof van het voedingsrantsoen
(hoe hoger, hoe minder doorspoeling, hoe gevaarlijker).
Soms gebruikt men azijnzuur ipv zoutzuur
(chloriden tasten roestvrijstaal aan). Dan verkrijgt men in
de glycerineoplossing:
- glycerine
- water
- natriumacetaat
Voor de rantsoenformulering vallen de chloriden
weg. Acetaat geeft geen problemen omdat deze direct voedsel
is voor de methanogenen en verdwijnt uit de vergister. Natrium
blijft de parameter dat men in het oog moet houden.
Volgende
pagina (2)...>>
|

